Após induzir o desenvolvimento de diabetes tipo 2 em camundongos com uma dieta rica em gordura, pesquisadores da Universidade Federal de São Carlos (UFSCar) trataram os animais com injeções de células-tronco mesenquimais.
A terapia, além de diminuir o processo de morte das células produtoras de insulina no pâncreas, aumentou a sensibilidade a esse hormônio no organismo dos roedores e reduziu de forma prolongada as taxas de glicemia no sangue.
O experimento foi conduzido durante o doutorado de Patricia de Godoy Bueno, no âmbito de um projeto apoiado pela FAPESP e coordenado pela professora Ângela Merice de Oliveira Leal, do Departamento de Medicina da UFSCar.
Os resultados foram divulgados no fim de abril, em artigo publicado na revista PLoS One.
“As células mesenquimais são muito interessantes do ponto de vista terapêutico, pois têm propriedades anti-inflamatórias, antiapoptóticas (evitam a morte celular) e imunomoduladoras. Elas costumam migrar para locais do corpo onde há inflamação. Outra vantagem é que o organismo não reage a elas como se fossem corpos estranhos, ou seja, não induzem rejeição”, explicou Leal.
Tanto em humanos como em roedores, essas células estão presentes em múltiplos órgãos, auxiliando no suporte e na sobrevivência dos tecidos e produzindo fatores tróficos (que garantem nutrição adequada para crescimento). Podem ser facilmente obtidas da medula óssea ou do tecido adiposo e expandidas em cultura de laboratório.
“As células mesenquimais se diferenciam em outros tipos de célula, como as de osso ou cartilagem. Mas os estudos feitos até agora sugerem que, no nosso caso, elas provavelmente não vão se diferenciar em células beta pancreáticas (produtoras de insulina). O que se acredita é que elas possam agir secretando fatores anti-inflamatórios e diminuindo a resistência à insulina nos tecidos periféricos”, disse Leal.
Modelo de estudo
No diabetes tipo 2, frequentemente associado à obesidade, o pâncreas produz insulina em níveis até mais elevados que o normal, mas as células dos tecidos periféricos, como fígado, tecido adiposo e músculos, tornam-se resistentes à ação do hormônio. O fenômeno pode ser explicado em parte pela inflamação induzida por moléculas secretadas pelo tecido adiposo.
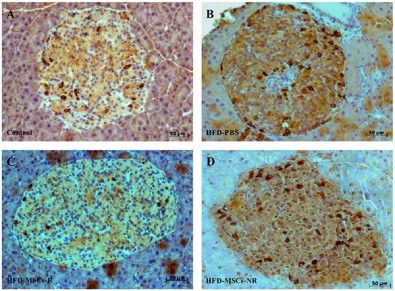
As células beta do pâncreas também são afetadas pela inflamação e pelo excesso de trabalho provocado pela resistência à insulina. Além de ter sua função alterada, tendem com o tempo a entrar em processo de apoptose ou morte celular programada, o que leva à diminuição da massa celular.
“Muitos estudos buscam simular o diabetes tipo 2 com o uso de animais geneticamente modificados ou administrando a roedores uma droga chamada streptozotocina, que destrói as células beta. Mas não é esse o processo da doença nos humanos obesos. Então, induzimos a doença nos camundongos administrando apenas uma dieta hiperlipídica”, contou Leal.
Na quarta semana de vida, os animais passaram a receber a dieta com 60% de gordura. Cerca de oito semanas depois já apresentavam aumento do peso, resistência à insulina e hiperglicemia. Foram então divididos em dois grupos. Metade foi tratada com placebo e, os demais, receberam quatro injeções das células mesenquimais com intervalos de uma semana.
Por serem mais fáceis de cultivar em laboratório, os pesquisadores optaram por usar células mesenquimais de rato e não de camundongo.
“Injetamos as células no espaço peritoneal (entre as camadas do peritônio, membrana que reveste a parte interna da cavidade abdominal e recobre as vísceras). É uma forma de administração pouco invasiva. Alguns estudos infundem via intravenosa, mas há risco de as células migrarem para o pulmão e causarem embolia”, disse a pesquisadora.
Os animais foram então avaliados semanalmente ao longo de quatro meses. No final do experimento, a sensibilidade à insulina estava aproximadamente 30% maior no grupo tratado. Já a taxa de glicemia em jejum caiu significativamente em 72% dos roedores que receberam a terapia celular.
“Também avaliamos a presença no pâncreas de uma proteína chamada caspase-3, envolvida na cascata de reações químicas que levam à apoptose. Observamos que o processo de morte celular programada foi menor nos animais tratados com as células mesenquimais”, disse Leal.
O nível de secreção de insulina no soro, porém, não se alterou em relação ao grupo não tratado. Segundo a pesquisadora da UFSCar, os resultados sugerem que a taxa de glicemia caiu em consequência de uma melhora na ação do hormônio nos tecidos periféricos. Os mecanismos por trás desse efeito ainda estão sendo estudados por seu grupo.
“Estamos investigando o que aconteceu em cada tecido no que diz respeito à ação da insulina. E também estamos testando a terapia em camundongos usando células mesenquimais humanas”, contou Leal.
Em outro projeto, também apoiado pela FAPESP e coordenado por Leal, o grupo da UFSCar avalia a eficácia das células-tronco mesenquimais no tratamento da neuropatia diabética, uma complicação comum da doença que pode causar dor, parestesia (sensações como formigamento ou queimação) e perda de sensibilidade, principalmente em pés e pernas.
No exterior, estão em andamento pelo menos três ensaios clínicos que avaliam a eficácia da terapia com células-tronco no diabetes tipo 2. O grupo da UFSCar, juntamente com a equipe da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (USP), submeteu um protocolo de estudo em humanos com diabetes tipo 2 para a avaliação da Comissão Nacional de Ética em Pesquisa (Conep) em 2012 e ainda aguarda julgamento.
“No caso de tratamento em humanos, não seria ideal usar células-tronco do próprio paciente diabético, pois há evidências de que elas possam ter suas propriedades afetadas pela hiperglicemia. Deveríamos recorrer a outras estratégias”, explicou Leal.
O artigo Metabolic and Pancreatic Effects of Bone Marr (doi: 10.1371/journal.pone.0124369), de Ângela Leal e outros, pode ser lido em http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0124369.