Publicado em julho 27, 2017 por bibliotecafsp
Efeito do envelhecimento na micróglia, célula do sistema nervoso central, pode elucidar evolução de doenças degenerativas
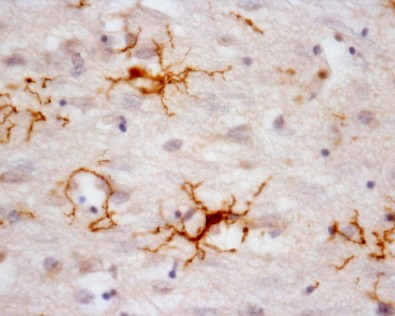
Estudo mostra que a micróglia humana tem muitos genes com expressão diferente da micróglia de camundongos, usada em estudos de doenças como Alzheimer. Trabalho foi publicado na Nature Neuroscience (imagem: micróglia humana (células em marrom)
Micróglia é um tipo de célula do sistema nervoso central com função similar à dos glóbulos brancos na corrente sanguínea. As micróglias fazem a vigilância ativa do tecido cerebral e da medula.
É sobre os genes de maior expressão na micróglia humana que trata uma colaboração entre pesquisadores do Brasil e da Holanda, cujos resultados foram publicados no site da revista Nature Neuroscience.
A pesquisa mostra que a micróglia humana tem muitos genes com expressão diferente da micróglia de camundongos, usada como modelos em estudos de doenças neurodegenerativas como Alzheimer.
O trabalho também indica que a micróglia humana envelhece de modo diferente da micróglia de camundongos. “Os resultados serão importantes para estudos do perfil de expressão gênica da micróglia normal ao longo do envelhecimento humano. Poderão servir de base para comparações que visem detectar as alterações da micróglia em diversas doenças neurodegenerativas”, disse Suely Nagahashi Marie, coordenadora do Laboratório de Biologia Molecular e Celular na Faculdade de Medicina da Universidade de São Paulo (FMUSP).
Micróglias têm terminações com as quais se prendem aos neurônios, inspecionando o ambiente em busca de agentes externos a combater, de sinapses mortas que devem ser retiradas ou ainda de neurônios que estão morrendo e precisam ser eliminados. Quando identificam algum problema, as micróglias se movem rapidamente para fagocitar o agente causador da inflamação.
As micróglias exercem ainda papel nas respostas imunológicas do sistema nervoso. Por conta disso, são objetos de pesquisas sobre doenças neurodegenerativas como Alzheimer, Parkinson e a esclerose lateral amiotrófica (ELA).
“Para poder desvendar qual o papel das micróglias nas doenças neurodegenerativas, em primeiro lugar é necessário entender quais são os genes da micróglia humana com maior expressão em um sistema nervoso saudável”, disse Thais Fernanda de Almeida Galatro, outra autora da pesquisa, da qual faz parte seu doutoramento, com orientação de Nagahashi Marie.
“Isso não havia sido feito. Nossa ideia foi estabelecer um perfil da expressão gênica da micróglia humana”, contou a biomédica, cujo doutorado foi feito em dupla titulação na FMUSP e na Universidade de Groningen, na Holanda. Galatro aprendeu uma técnica de obtenção das micróglias no córtex cerebral com a equipe do professor Bart Eggen, no Departamento de Neurociência da universidade holandesa. A colaboração entre os pesquisadores envolveu a vinda de uma integrante da equipe de Eggen para o laboratório coordenado por Nagahashi Marie.
As amostras de córtex cerebral usadas na pesquisa foram coletadas em autópsias realizadas na Holanda e no Serviço de Verificação de Óbitos da Capital (SVOC) do Banco de Encéfalos Humanos do Grupo de Estudos em Envelhecimento Cerebral da FMUSP.
Das 81 amostras, foram selecionadas 39 “de indivíduos sem histórico de patologia cerebral, para termos a certeza de que as micróglias do estudo seriam de cérebros sadios”, contou Galatro.
As amostras selecionadas eram de mulheres e homens com idades entre 34 e 102 anos. Tal amplitude etária foi intencional, visando entender de que modo o processo de envelhecimento afetaria a expressão gênica das micróglias.
A partir das amostras de córtex foram obtidas as micróglias, momento em que se partiu para o sequenciamento de seu transcriptoma, ou seja, o conjunto dos RNAs da micróglia, fornecendo assim um reflexo direto da expressão gênica.
“A metodologia de sequenciamento em larga escala (NGS) permite verificar o nível de expressão de todos os genes codificados na amostra estudada. No nosso trabalho, utilizamos a técnica de depleção do RNA ribossomal, que representa cerca de 80% do RNA total da micróglia”, disse Nagahashi Marie.
Isso permitiu a melhor contagem dos RNAs mensageiros, aqueles responsáveis pela codificação das proteínas. Os pesquisadores detectaram entre 17 e 19 mil genes da micróglia humana. “Esse universo de genes foi comparado em dois grupos: micróglia isolada versus cérebro total”, disse.
A micróglia representa um compartimento celular específico do tecido cerebral. Na comparação da micróglia com o cérebro total, os 17 a 19 mil genes foram ordenados de acordo com a abundância em cada um desses compartimentos. A partir dali, foi possível identificar os 1.297 genes que estão expressos em maior abundância na micróglia humana.
“Este grupo de genes foi considerado como sendo a assinatura molecular da micróglia humana”, disse Nagahashi Marie.
Uma vez isolados os 1.297 genes com maior expressão na micróglia humana, sua classificação foi feita comparando-os aos genes da micróglia dos camundongos, o animal do qual mais se estudou o papel das micróglias.
“Identificamos que, de maneira geral, os genes com maior expressão na micróglia humana são semelhantes aos genes de maior expressão na micróglia murina (dos camundongos)”, disse Galatro.
A maioria dos genes está relacionada, tanto em humanos quanto em camundongos, com a função de movimento (as micróglias se movem pelo tecido nervoso) e a função de defesa (na fagocitose de agentes patológicos).
No entanto, uma pequena porção dos genes de maior expressão na micróglia humana não encontra correspondente nos genes da micróglia murina.
“Descobrimos que aqueles poucos genes exclusivamente humanos têm papel na resposta imune, ou seja, eles são importantes na defesa do hospedeiro contra as infecções”, disse Galatro.
Comparação com primatas
Segundo Nagahashi Marie, o principal resultado da pesquisa foi justamente a demonstração de que, apesar da observação de uma sobreposição de genes nas micróglias de seres humanos e camundongos, a micróglia humana apresenta vários genes com expressão diferente da murina.
“Isso implica que os resultados dos experimentos nos modelos murinos de neurodegeneração, incluindo os modelos de Alzheimer, devem ser interpretados com esta cautela”, disse. “Nossos resultados de expressão da micróglia humana ao longo do envelhecimento diferem dos já descritos no modelo murino de envelhecimento.”
Na sequência da pesquisa, o grupo pretende analisar funcionalmente os genes identificados para conhecer o seu papel na fisiologia normal do tecido cerebral e compreender as suas mudanças nas doenças neurodegenerativas.
Uma vez comparados os genes humanos com os de camundongos, é natural querer fazer comparações com as micróglias de animais evolutivamente mais próximos do homem.
“O sequenciamento da micróglia de primatas está em andamento em nosso laboratório. Com a produção do transcriptoma de primatas teremos condições de comparar a expressão gênica evolutiva da micróglia humana com a micróglia de primatas, de camundongos e do peixe-zebra”, disse Nagahashi Marie.
Os pesquisadores também estão com o sequenciamento pronto e em fase de análise bioinformática da expressão da micróglia isolada de sete regiões distintas do cérebro de autópsia de indivíduos sem disfunção cognitiva.
“O novo estudo possibilitará analisar se a micróglia apresenta diferenças em sítios distintos do cérebro. Partimos da hipótese que sim, e que a micróglia é relevante na patologia das doenças neurodegenerativas. Por conta disso, incluímos na análise os sítios que sofrem comprometimento no avanço progressivo da doença de Alzheimer”, disse.
A pesquisa contou com apoio da FAPESP por meio de Bolsa de Doutorado, Auxílio à Pesquisa e de Projeto Temáticocoordenado pela professora Berenice Bilharinho de Mendonça, da FMUSP.
Outra colaboração fundamental veio do professor Carlos Pasqualucci, chefe do SVOC. Atualmente na Universidade de Michigan, o endocrinologista brasileiro Antonio Lerario foi o responsável pela análise de bioinformática do trabalho.
O artigo Transcriptomic analysis of purified human cortical microglia reveals age-associated changes (doi:10.1038/nn.4597), de Thais F. Galatro, Inge R. Holtman, Antonio M. Lerario, Suely K.N. Marie e outros, pode ser lido em www.nature.com/articles/doi:10.1038/nn.4597 e será publicado na edição impressa da Nature Neuroscience.