Um medicamento capaz de combater a hipertensão arterial por um mecanismo inovador vem sendo testado, com apoio da FAPESP, por um grupo que reúne pesquisadores brasileiros, ingleses e neozelandeses.
Os resultados mais recentes dos ensaios pré-clínicos com o composto – por enquanto denominado MK-7264/AF-219 – foram divulgados este mês na revista Nature Medicine.
Os testes em humanos já estão sendo planejados na Inglaterra. Caso a terapia se mostre eficaz e segura, poderá beneficiar também pacientes com hipertensão resistente, ou seja, que não respondem aos tratamentos farmacológicos atualmente disponíveis.
“Este novo medicamento atua bloqueando uma classe de receptores celulares conhecidos como P2X3, ou receptores purinérgicos, presentes em um órgão chamado corpúsculo carotídeo, localizado nas artérias carótidas. Essas células estão anormalmente ativadas em indivíduos hipertensos”, explicou Benedito Honorio Machado, professor do Departamento de Fisiologia da Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo (FMRP-USP).
O medicamento foi desenvolvido pelo laboratório Afferent Pharmaceuticals, atualmente pertencente à Merck, com base em resultados de pesquisas conduzidas ao longo das últimas décadas pelos grupos coordenados por Machado, na USP, e pelo professor Julian Paton, na Universidade de Bristol, Inglaterra. Por meio da cooperação que perdura há mais de 15 anos foram desenvolvidos estudos relacionados à caracterização dos receptores purinérgicos e ao controle cardiovascular. Também colaboraram cientistas da Universidade de Auckland, da Nova Zelândia.
Conforme explicou Machado, o medicamento impede que o receptor P2X3 seja ativado pelo seu “ligante” – no caso, o ATP (adenosina trifosfato, molécula que armazena energia para as atividades celulares). Isso faz com que as células do corpúsculo carotídeo, que nos hipertensos estão hiperativas, voltem ao padrão de atividade considerado normal.
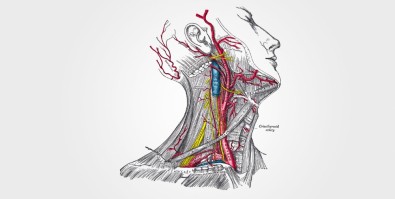
Do tamanho de um grão de arroz, o corpúsculo carotídeo é considerado o menor órgão do corpo humano. Existem dois corpúsculos carotídeos, sendo um em cada artéria carótida responsável por levar o sangue rico em oxigênio que vem do coração para o cérebro.
“Os corpúsculos carotídeos ficam na região do pescoço, onde as artérias carótidas se bifurcam. Funcionam como sensores que alertam o sistema nervoso central quando, por algum motivo, o nível de oxigênio no sangue diminui. Quando esse sinal de alerta chega ao cérebro, é desencadeada uma resposta de aumento da atividade simpática, que faz aumentar a frequência cardíaca e a resistência vascular à passagem do fluxo sanguíneo, causando aumento da pressão arterial. Ocorre também o aumento da respiração para aumentar o aporte de oxigênio para o cérebro”, contou Machado.
Esse é um sistema de defesa necessário, por exemplo, durante um episódio de apneia obstrutiva do sono. A queda na oxigenação causa a ativação das células do corpúsculo carotídeo, que enviam o sinal de alerta para o cérebro.
Em condições fisiológicas, após a normalização do nível de oxigênio do sangue, a atividade simpática volta ao normal, bem como a pressão arterial. Mas experimentos com ratos feitos na FMRP-USP indicaram que, em animais hipertensos, essas células ficam constantemente mandando sinais para o cérebro aumentar a atividade simpática.
“Todos os medicamentos contra a hipertensão hoje disponíveis no mercado interferem nos efeitos finais dessa hiperatividade simpática, ou seja, nas terminações neurais dos vasos e do coração, induzindo a vasodilatação e a queda da pressão arterial. Este novo medicamente vai combater a hipertensão na sua origem, evitando o aumento da atividade simpática”, afirmou Machado.
Os ensaios
Nos experimentos feitos na USP, pelo professor Davi José de Almeida Moraes e pela pesquisadora Melina Pires da Silva, ambos do Departamento de Fisiologia da FMRP, foi usada uma linhagem de ratos que espontaneamente se tornam hipertensos a partir de cinco semanas de vida – resultado de anos de cruzamento entre animais com pressão arterial elevada.
Para medir o nível de atividade das células do corpúsculo carotídeo em diferentes situações, os pesquisadores usaram técnicas de eletrofisiologia, ou seja, por meio de microeletrodos mediram a atividade de um grupo de neurônios – localizados em gânglios na região do pescoço dos ratos – responsáveis por levar os sinais emitidos pelo corpúsculo carotídeo até o cérebro.
“Por meio do registro da atividade neural, observamos que as células do corpúsculo carotídeo dos animais hipertensos estão continuamente mais ativadas que as dos animais controle. Além disso, quando os animais são submetidos a uma situação de redução de oxigênio, as células dos hipertensos respondem de forma mais exacerbada”, contou Moraes.
Na tentativa de desvendar a causa dessa maior excitabilidade, os pesquisadores decidiram estudar os receptores do tipo P2X3. Notaram que além de estarem mais expressos nas células dos ratos hipertensos, eles também respondem exageradamente quando o ATP é aplicado no local.
Por meio de análises histológicas, esse estudo mostrou que nas células do corpúsculo carotídeo humano esses receptores também são expressos.
O passo seguinte foi testar o efeito do tratamento com o bloqueador do P2X3 em animais. Inicialmente, o composto MK-7264/AF-219 foi aplicado diretamente no corpúsculo carotídeo dos ratos hipertensos e, por meio do registro da atividade neural, o grupo observou diminuição na atividade desses neurônios e também na atividade simpática.
O efeito do medicamento sobre a pressão arterial foi testado por meio de um tratamento agudo feito por via endovenosa. Os animais hipertensos receberam uma infusão do bloqueador durante 60 minutos e, em seguida, tiveram a pressão monitorada por mais uma hora.
“Nesse período os valores pressóricos ficaram semelhantes ao de animais normotensos. Depois disso, a pressão arterial tende a voltar para os níveis elevados. Para potencializar o efeito nos ensaios clínicos, será preciso planejar cuidadosamente a dose para a administração oral”, comentou Moraes.
Um primeiro indício de que a nova estratégia terapêutica pode funcionar em humanos foi também demonstrado no estudo divulgado na Nature Medicine. Em um experimento feito na Inglaterra, pacientes hipertensos receberam por via endovenosa durante cinco minutos o neurotransmissor dopamina – substância capaz de inibir a atividade do corpúsculo carotídeo. O tratamento causou diminuição na respiração dos voluntários, indicando que em humanos hipertensos os corpúsculos carotídeos também estão hiperativos.
“Acreditamos que essa estratégia usando a dopamina poderá ajudar, no futuro, a identificar quais pacientes poderão se beneficiar com os bloqueadores de P2X3. Nem todos os casos de hipertensão estão relacionados com a hiperatividade das células do corpúsculo carotídeo”, comentou Moraes.
De acordo com o pesquisador, a remoção cirúrgica de um dos corpúsculos carotídeos já foi testada na Inglaterra como um tratamento para casos de hipertensão maligna – aqueles que não são controlados com medicamentos. Na maioria dos pacientes submetido a esse procedimento foi observada redução da pressão arterial e melhora da qualidade de vida.
“A desvantagem desse método é o fato de envolver cirurgia em uma região muito delicada. Além disso, não se pode remover os dois corpúsculos carotídeos, pois o paciente correria o risco de morrer durante um episódio de apneia do sono, por exemplo. Já com o bloqueador de P2X3, o sistema de alarme do organismo continua funcionando, ele apenas deixa de estar mais ativado do que deveria”, disse Machado.
Já há testes clínicos em andamento com o composto MK-7264/AF-219 para o tratamento de tosse crônica, condição também relacionada à hiperatividade dos receptores purinérgicos. “O composto já foi aprovado nos primeiros testes para avaliação de toxicidade e já se encontra em fase adiantada dos ensaios clínicos”, disse Machado
O artigo Purinergic receptors in the carotid body as a new drug target for controlling hypertension (doi: 10.1038/nm.4173), pode ser lido em www.nature.com/nm/journal/vaop/ncurrent/full/nm.4173.html.