Uma pesquisa em andamento no Instituto de Ciências Biomédicas (ICB) da Universidade de São Paulo (USP) tenta desvendar como o sistema endocanabinoide está envolvido no processo neurodegenerativo que acomete portadores da doença de Parkinson.
O sistema endocanabinoide é formado por um conjunto de neurotransmissores quimicamente semelhantes a compostos químicos existentes na maconha (Cannabis sativa) e por seus receptores cerebrais.
De acordo com Andrea da Silva Torrão, coordenadora da pesquisa apoiada pela FAPESP, esse conhecimento poderá ajudar no desenvolvimento de novas ferramentas terapêuticas.
“Os primeiros resultados obtidos mostram que o sistema de neurotransmissão endocanabinoide está envolvido na doença de Parkinson, mas ainda não sabemos se para o bem ou para o mal. Conhecendo melhor como ele se comporta, poderemos ir atrás de drogas capazes de pelo menos melhorar a qualidade de vida dos pacientes”, disse Torrão.
A doença de Parkinson é resultante da perda progressiva de neurônios que produzem o neurotransmissor dopamina e estão situados em um núcleo cerebral relacionado ao controle de movimentos conhecido como substância negra.
“A substância negra faz parte de um grande complexo cerebral denominado núcleos da base. Uma das funções dos núcleos da base é a organização dos movimentos voluntários”, explicou a pesquisadora.
Quando a perda dos neurônios dopaminérgicos ultrapassa 50%, começam a se manifestar sintomas como tremores de repouso, rigidez muscular, bradicinesia (lentidão de movimento) e acinesia (imobilidade). A doença também costuma causar depressão, problemas cognitivos e, em estágio avançado, demência.
Para tentar descobrir o que dispara a degeneração dos neurônios dopaminérgicos e entender como o sistema endocanabinoide participa do processo, os pesquisadores do ICB induziram um quadro semelhante ao Parkinson em ratos.
“Os endocanabinoides têm a função de neuromodulação. Fazem uma espécie de ajuste fino das sinapses e controlam a liberação de outros transmissores dos neurônios. Os receptores canabinoides CB1 ficam principalmente nos terminais axônicos de dois tipos de neurônios: os gabaérgicos – que usam como mediador o ácido gama-aminobutírico (GABA) – e os glutamatérgicos – que usam como mediador o glutamato. Ambos existem em grande quantidade nos núcleos da base”, disse Torrão.
Os experimentos com modelo animal foram realizados durante o doutorado de Gabriela Pena Chaves-Kirsten, com Bolsa da FAPESP. Parte dos resultados foi publicada na revista PLoS One.
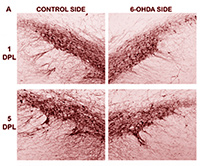
A morte dos neurônios dopaminérgicos foi provocada em apenas um dos hemisférios cerebrais com a injeção de uma neurotoxina conhecida como 6-hidroxidopamina.
“Por meio de um procedimento cirúrgico, injetamos essa substância diretamente no estriado, um dos componentes dos núcleos da base. Após uma ou duas semanas é possível observar uma perda significativa dos neurônios dopaminérgicos e, por meio de testes comportamentais, vimos que o animal já apresentava déficit locomotor”, contou Torrão.
Em uma primeira etapa da pesquisa, os cientistas avaliaram como a expressão do receptor CB1 era alterada com a injeção da neurotoxina.
Quatro estruturas dos núcleos da base foram monitoradas: o estriado, as porções externa e interna do chamado globo pálido e a outra parte da substância negra que não contém os neurônios dopaminérgicos e é conhecida como porção reticulada. “Todas essas regiões cerebrais estão envolvidas no controle locomotor e dependem da informação dos neurônios dopaminérgicos”, explicou Torrão.
O nível de expressão de CB1 foi medido no primeiro, no quinto, no décimo, no vigésimo e no sexagésimo dia após a indução da morte neuronal. Enquanto no estriado os pesquisadores não observaram nenhuma alteração, na porção reticulada da substância negra a expressão da proteína estava diminuída já a partir do primeiro dia.
Por outro lado, o globo pálido apresentou um padrão bifásico nos níveis de CB1. Na sua porção externa (EGP), houve um aumento inicial de aproximadamente 40% em relação ao lado controle, seguido de uma diminuição gradativa ao longo do tempo. No quinto dia, a expressão era 25% maior que no lado controle e, no vigésimo dia, já estava igual. No sexagésimo dia, estava 20% menor do que no grupo controle.
Na porção interna do globo pálido (IGP), foi observado um aumento da expressão de CB1 de 50% em relação ao controle apenas no primeiro dia. A partir do quinto dia houve uma diminuição gradual, chegando a 60% abaixo do lado controle no sexagésimo dia.
“Acreditamos que esse aumento inicial observado em algumas estruturas dos núcleos da base esteja relacionado a um processo compensatório de plasticidade neural envolvendo a transmissão gabaérgica. Parece ser uma tentativa do sistema nervoso de compensar a falta dos neurônios dopaminérgicos. Mas a estratégia acaba falhando, pois a degeneração neuronal continua ocorrendo e os sintomas motores se agravam”, avaliou Torrão.
Testes com drogas
Em uma segunda etapa da pesquisa, o grupo decidiu tratar os ratos com compostos canabinoides para tentar reverter o processo de degeneração neuronal. Dois tipos de substâncias foram testados: os antagonistas canabinoides, que bloqueiam o receptor, e os agonistas canabinoides, drogas quimicamente semelhantes aos compostos ativos extraídos da maconha e aos endocanabinoides.
Os animais foram divididos em três grupos. O primeiro recebeu apenas a substância agonista, o segundo, a antagonista e o terceiro, placebo.
O tratamento começou no dia seguinte à injeção de 6-hidroxidopamina e durou quatro dias. Além de avaliações comportamentais dos sintomas locomotores, os pesquisadores acompanharam a degeneração neuronal por meio de ensaios de imunoistoquímica, que mediam a expressão de dopamina.
“O tratamento com o agonista canabinoide aparentemente piorou os sintomas motores e a degeneração dopaminérgica e, portanto, parece não ser uma boa opção de terapia. Já o composto antagonista, embora não tenha conseguido evitar a morte progressiva dos neurônios, conseguiu ao menos melhorar os sintomas motores nos ratos. Mas ainda não sabemos exatamente como”, contou Torrão.
A hipótese, acrescentou a pesquisadora, é que, ao conseguir bloquear o aumento inicial na expressão da proteína CB1, a droga retardaria a evolução dos sintomas motores. Na tentativa de compreender melhor os achados, os pesquisadores do ICB/USP estão realizando agora estudos in vitro com as drogas.
“É mais fácil estudar mecanismos moleculares em culturas de células, pois é uma situação com menos variáveis, na qual não há outros processos metabólicos para interferir”, disse Torrão.